文章来源: 类器官和器官芯片
序言

2024年8月,Calvin J. Kuo团队在《Nature》杂志上发表了一篇题为“A human autoimmune organoid model reveals IL-7 function in coeliac disease”的研究文章。这项研究由斯坦福大学医学院的团队领导,他们开发了一种新型的人类自身免疫类器官模型,用于研究乳糜泻(CeD)的病理机制。通过使用空气-液体界面(ALI)技术,研究者们能够从内窥镜活检样本中培养出保留了上皮和原生间质以及组织驻留免疫细胞的十二指肠类器官。这些类器官不仅模拟了CeD患者的病理特征,还揭示了IL-7在调节CD8+ T细胞介导的上皮细胞破坏中的关键作用。研究结果为理解CeD的免疫病理学提供了新的视角,并为开发新的治疗策略提供了潜在的靶点。
摘要
自身免疫的体外模型受到无法培养受影响的上皮组织以及复杂的组织驻留免疫微环境的限制。乳糜泻(CeD)是一种自身免疫性疾病,其中饮食中的谷蛋白衍生肽与主要组织相容性复合体(MHC)类II人类白细胞抗原分子(HLA)-DQ2或HLA-DQ8结合,引发免疫介导的十二指肠粘膜损伤。在这里,我们从内窥镜活检的完整片段中生成了空气-液体界面(ALI)十二指肠类器官,这些类器官保留了上皮组织以及原生间充质和组织驻留免疫细胞作为一个单元,而不需要重建。ALI类器官的免疫多样性涵盖了T细胞、B细胞和浆细胞、自然杀伤(NK)细胞和髓系细胞,具有广泛的T细胞和B细胞受体库。HLA-DQ2.5限制性的谷蛋白肽选择性地在来自CeD患者的HLA-DQ2.5表达类器官中引发上皮破坏,这可以通过阻断MHC-II或NKG2C/D来抵消。谷蛋白表位刺激了CeD类器官在淋巴细胞和髓系亚群中的免疫网络响应,以及抗转谷氨酰胺酶2(TG2)自身抗体的产生。在CeD类器官的功能研究中发现,白细胞介素-7(IL-7)是一种谷蛋白诱导的致病调节因子,它调节CD8+ T细胞NKG2C/D的表达,并且对上皮破坏是必要且充分的。此外,与采用无谷蛋白饮食的缓解期疾病相比,活跃期CeD患者的活检样本中的内源性IL-7显著上调,主要在固有层间充质中。通过保留上皮组织以及多样化的免疫群体,这种人类体外CeD模型重现了依赖谷蛋白的病理学,使得机制研究成为可能,并为自身免疫病的类器官建模建立了一个原理验证。
研究成果

图1 人ALI小肠类器官保存上皮细胞、间充质细胞和多种免疫细胞群,而无需外源性重建

图2 谷蛋白诱导CeD类器官中的上皮IL-15产生和凋亡

图3 醇溶蛋白诱导CeD类器官中T细胞扩增
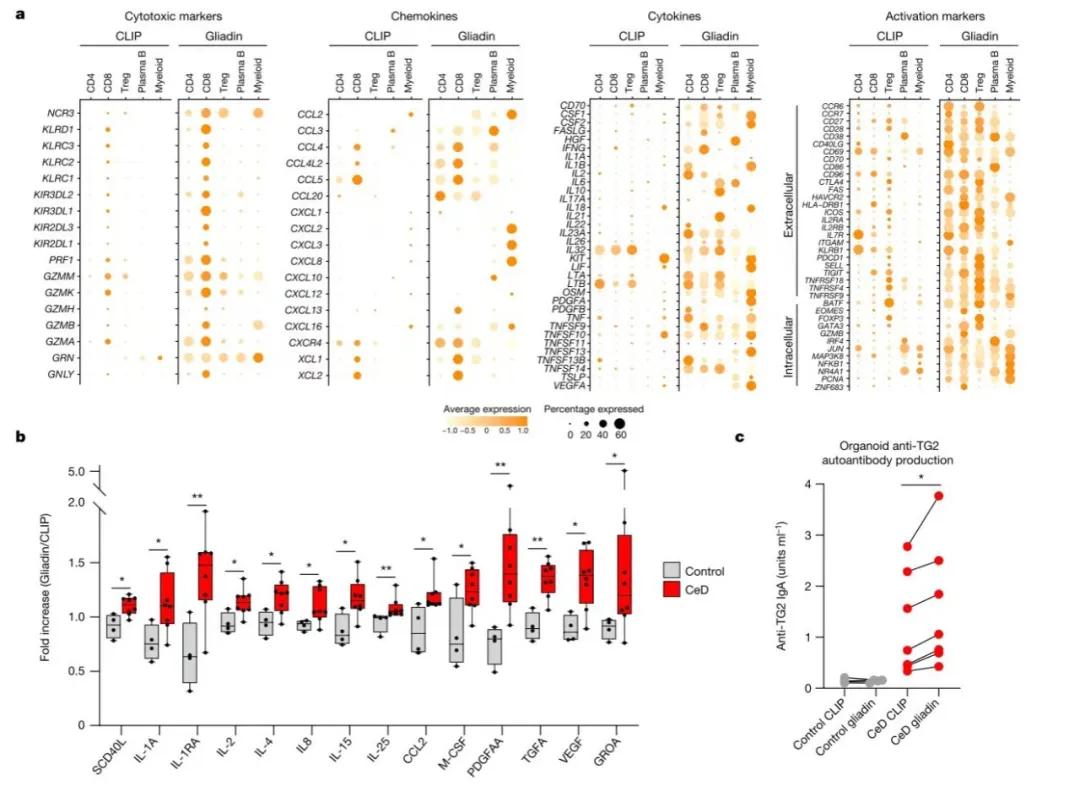
图4 谷蛋白诱导CeD类器官的网络适应性和先天性免疫反应

图5 IL-7在谷蛋白诱导的CeD类器官细胞毒性过程中的必要性和充分性

图6 在CeD类器官中,谷蛋白增加了IL-7的产生,并在活性CeD活检中上调
研究意义
本研究通过创建一个包含多样化免疫细胞的人类自身免疫类器官模型,成功模拟了乳糜泻(CeD)的病理过程,揭示了IL-7在促进麦胶诱导的上皮细胞损伤中的核心作用。这一发现不仅增进了对CeD发病机制的理解,而且为开发针对IL-7的治疗策略提供了科学依据,有望改善CeD患者的临床治疗,并为其他自身免疫性疾病的研究提供了新的视角和方法。
编辑:田锦鑫
排版:赵一铮
初审:孙世欣
复审:李刚
终审:闫晓倩 张兴众
免责声明:本文仅作知识交流与分享及科普目的,不涉及商业宣传,不作为相关医疗指导或用药建议。文章如有侵权请联系删除。
本公司产品推荐:
1.119431-25-3 https://www.bicbiotech.com/product_detail.php?id=5881
2.52986-70-6 https://www.bicbiotech.com/product_detail.php?id=5882
3.68285-25-6 https://www.bicbiotech.com/product_detail.php?id=5883
4.183322-45-4 https://www.bicbiotech.com/product_detail.php?id=5884
5.90806-58-9 https://www.bicbiotech.com/product_detail.php?id=2905




