文章来源:光谱与液芯器械医工交叉团队
与动物模型或2D模型相比,器官芯片(OOC)模型能够以相对可控的方式更好地重现细胞微环境。通过使用OOC模型,研究人员能够定义和控制细胞所处的几何形状、基质材料以及流体控制,从而仿生模拟体内细胞的微环境,使其表现得与体内组织/器官相似,从而提高对体内行为的可预测性。传统的微流体器官芯片(OOC)模型通常采用矩形截面和扁平壁的设计,这限制了对管状组织(如肾小管)的有效模拟。
针对这一问题,来自荷兰埃因霍芬理工大学的 Jaap M. J. den Toonder 教授团队在《Advanced Science》期刊发表了题为“A Cell Pre-Wrapping Seeding Technique for Hydrogel-Based Tubular Organ-On-A-Chip”的文章。提出了一种新型细胞预包裹接种技术,通过将细胞载体包裹在3D打印的牺牲糖基纤维模板周围,创建具有圆形截面的管状OOC模型。该技术能够实现均匀的细胞分布和融合细胞单层的形成。并展示了一个可灌注的肾近端小管芯片,直径小至50 μm,具有分支和曲率的细胞管状结构,以及初步的血管-肾小管相互作用模型。该细胞预包裹接种技术为构建多样的生理/病理模型提供了可能性,为机制研究和药物开发提供了管状OOC系统。
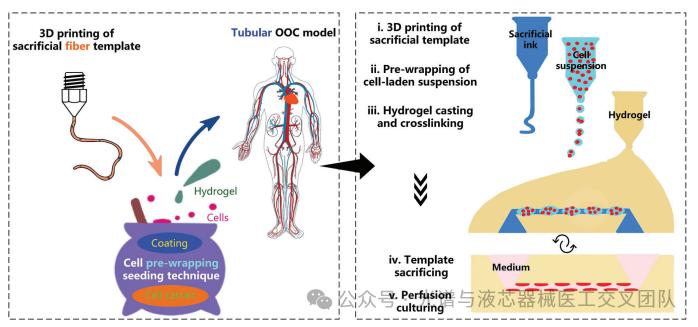
主要内容:
1.糖基纤维和腔体结构的打印与细胞预包裹接种技术方法优化
为制造出具有圆形横截面和复杂几何形状的模板,以模拟生理管道结构。基于丝状挤出3D打印技术和牺牲模板成型,将糖基材料作为牺牲材料,3D打印具有管腔结构的纤维。通过控制打印参数(如温度、压力和打印速度),可以调整糖基纤维的直径,范围从50 μm到1 mm。糖基纤维的直径随着挤出温度和压力的增加而增加,而随着喷嘴的移动速度的增加而减少。温度的影响可以通过更高的挤出温度导致熔融糖的粘度降低来解释,因此在相同的挤出压力下,单位时间内挤出的糖量增加,从而导致纤维直径的增加。更高的挤出压力也导致挤出更多的糖,这再次导致更厚的纤维。喷嘴移动速度的影响则是因为在更高速度下,纤维被拉伸得更多,从而使纤维变得更细。通过规定打印路径,可以实现多种管状结构。
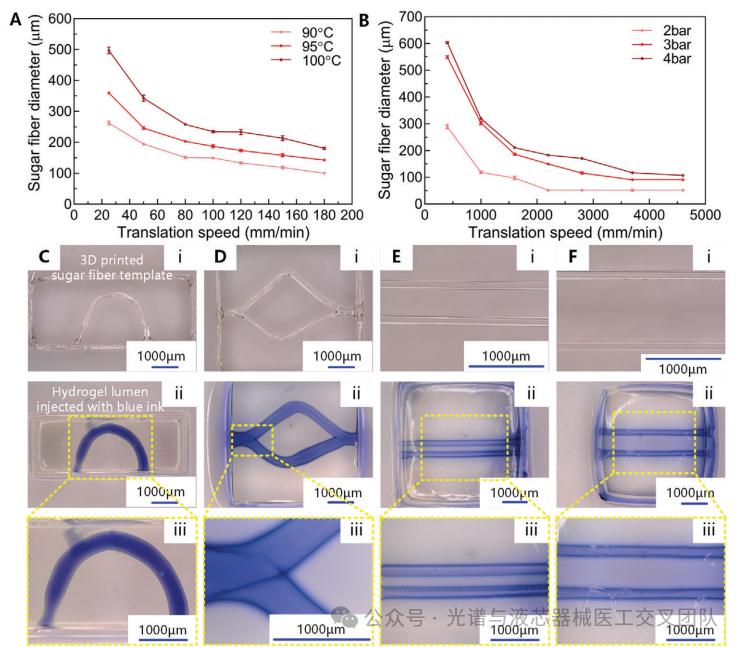
图1 生成3D肿瘤球的三种方法并用于构建血管化肿瘤微流控模型
使用纤维蛋白作为细胞载体。将细胞悬浮在含有凝血酶的溶液中,然后与纤维蛋白原溶液混合,形成细胞载体。将细胞载体(含有细胞的纤维蛋白)放置在涂覆有PDLGA和F-127的糖基纤维表面,进行预包裹接种。通过印章技术,将细胞载体均匀地包裹在糖基纤维周围。在细胞接种后,进行细胞培养,并监测细胞的附着和增殖情况,使用荧光显微镜观察细胞的形态和分布。结果表明,细胞在简单培养基中的悬浮状态,细胞大部分处于漂浮状态,难以附着。而包裹在纤维蛋白中的细胞培养3天后仍固定在初始位置,显示出纤维蛋白对细胞的良好固定能力。细胞在纤维蛋白降解后,细胞开始迁移并在糖基纤维表面形成均匀的细胞单层,避免了细胞在后续操作中的流失,这为实现均匀的细胞分布奠定了基础。通过在糖基纤维表面涂覆PDLGA和F-127,可以降低与包裹细胞悬液的基质胶的接触角,从而促进细胞在糖基纤维表面的接种。将糖基纤维牺牲掉后,接种上皮细胞。结果显示,显示了细胞在水凝胶内的分布情况,强调了细胞与水凝胶的良好结合,形成单层细胞层。

图2细胞预包裹接种的关键步骤
2.基于细胞预接种工程化制备可灌注微流体管状微生理细胞模型
通过细胞预包裹接种技术工程化可灌注微流体管状微生理细胞模型的完整工作流程,具体实验方法如下:1)3D打印糖基纤维结构:首先,通过3D糖打印技术制造悬浮的糖基纤维结构作为牺牲模板。打印过程中,调节打印参数以获得所需的结构。2)涂层处理:在糖基纤维上涂覆PDLGA和F-127,以保护糖基纤维免受早期溶解并提高其亲水性,以促进细胞的均匀接种。3)细胞接种:使用细胞载体(纤维蛋白)进行细胞预包裹接种,确保细胞均匀地附着在糖基纤维表面。4)水凝胶浇铸和交联:在细胞接种后,将水凝胶(如GelMA)浇铸到糖基纤维结构周围,并进行紫外线交联以固化水凝胶。5)糖模板溶解:将整个构建体浸泡在培养基中,选择性溶解糖基纤维模板,形成细胞化的管状结构。6)灌注培养:通过连接微流体泵系统进行灌注培养,以模拟生理条件。实验结果表明,细胞在糖基纤维表面的均匀分布和良好的生长状态,表明细胞预包裹接种技术有效地解决了传统细胞接种中的不均匀性问题。糖模板溶解后,形成的管状结构具有生理相关性,能够更好地模拟体内肾小管的功能。在灌注培养下,细胞表现出良好的生长和增殖,表明所构建的模型能够模拟生理条件下的细胞行为。
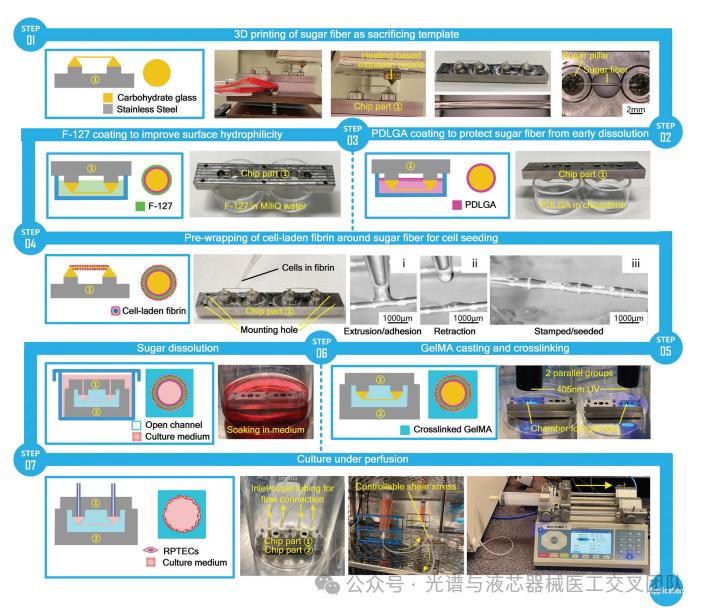
图3 生成3D肿瘤球的三种方法并用于构建血管化肿瘤微流控模型
3.肾近端小管芯片模型构建
使用荧光显微镜观察不同直径(400 μm、200 μm和50 μm)管腔内肾近端小管上皮细胞(RPTECs)的生长情况,通过评估细胞的活力和增殖,以及在不同流速下进行流体剪切应力(FSS)实验以分析其对细胞形态和功能的影响。实验结果表明,RPTECs在管腔内均匀生长,形成良好的单层结构,细胞活力保持在90%以上且数量逐渐增加。不同的剪切力对细胞功能的影响显著。适度的流体剪切应力(如0.13 dyne/cm²)有助于维持细胞的正常形态、增强细胞间的相互作用和功能,模拟了体内生理环境。然而,随着剪切力的增加,细胞的形态和功能受到负面影响,表现出细胞排列不规则、连接性下降,甚至可能导致细胞的损伤和死亡。因此,在设计肾近端小管芯片模型时,优化流体剪切应力是至关重要的,以确保细胞的健康生长和功能表现。
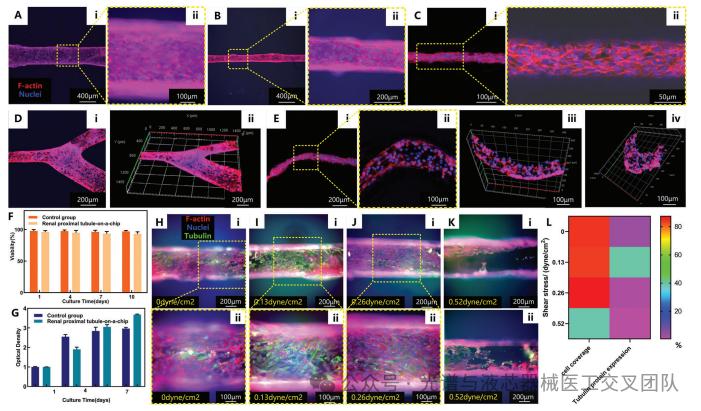
图4 肾近端小管芯片模型的表征
4.血管-肾小管相互作用模型构建
通过在相邻的平行通道中分别预先接种人脐静脉内皮细胞(HUVECs)和肾近端小管上皮细胞(RPTECs)来构建,体现了生理状态下肾小管与血管之间的相互作用。首先打印了两个平行的糖基纤维,直径为400 μm,间距为500 μm,然后在各自的通道中接种了HUVECs和RPTECs。通过荧光显微镜观察,结果显示这两种细胞均能良好附着并在腔内扩展,形成了相互独立的管腔结构,表明该方法能够有效构建具有生理相关性的细胞模型。通过FITC-标记的右旋糖酐渗透实验,评估内皮化腔的屏障功能。实验结果表明,内皮化腔对FITC-标记的右旋糖酐表现出显著的渗透屏障作用,随着时间推移,荧光强度的变化显示了内皮细胞层的有效性。这一发现进一步证实了内皮细胞在调节物质交换和维持组织屏障方面的重要角色。总体而言,该研究为肾脏疾病模型的建立提供了新的思路,展示了通过细胞共培养技术构建复杂生物模型的潜力,未来可用于深入研究肾脏功能、疾病机制及药物筛选等方面。
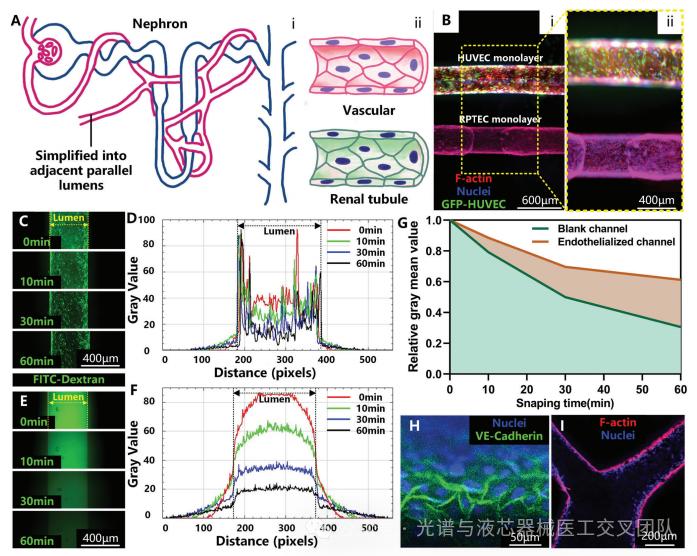
图5 血管-肾小管相互作用模型构建与表征
原文链接:https://doi.org/10.1002/advs.202400970
免责声明:本文仅作知识交流与分享及科普目的,不涉及商业宣传,不作为相关医疗指导或用药建议。文章如有侵权请联系删除。
本公司产品推荐:
1.65874-27-3 https://www.bicbiotech.com/product_detail.php?id=6469
2.87184-99-4 https://www.bicbiotech.com/product_detail.php?id=6470
3.104670-74-8 https://www.bicbiotech.com/product_detail.php?id=6275
4.1214376-88-1 https://www.bicbiotech.com/product_detail.php?id=6276
5.30319-05-2 https://www.bicbiotech.com/product_detail.php?id=6277




