前言
血浆蛋白结合(PPB)是药物研发中的关键参数。对于高结合率(fu < 1%)、大分子量、高亲脂性或易发生非特异性结合的化合物,常规测定方法易因平衡不完全、检测灵敏度不足等问题导致结果偏差。本文主要学习高血浆蛋白结合率化合物PPB测定的常见方法——平衡透析法及其改进策略。
该方法的核心原理是将加有待测化合物的血浆(供体侧)与缓冲液(接收侧)用半透膜隔开,在37°C下孵育至平衡后,分别测量两侧的化合物浓度,从而计算游离分数(fu)。针对不同特性的化合物(如高结合率化合物)和不同的实验设备,衍生出了以下几种具体实验方案(不同实验平台的方法/参数细节可能存在差异)。
一、 基本实验流程与通用步骤
方法的共同起点是血浆样品的准备:人体血浆在37°C水浴中解冻,使用1 mol/L盐酸将其pH值调节至7.4。将化合物的DMSO储备液(通常为200 μmol/L)按1:100比例加入血浆或稀释血浆中,使化合物的最终浓度为2 μmol/L,DMSO最终浓度为1%(预饱和法为0.5%)。使用移液器充分混匀。
孵育结束后,采用类似的样品处理方法:取一定体积的样品,通过加入含质谱内标的冷乙腈进行蛋白沉淀。涡旋混合后离心,取上清液进行LC-MS/MS分析。每个实验设置阳性对照作为质控(QC)样品,并进行至少3次平行实验。
数据分析中,在早期药物发现的非确证性实验中,直接使用分析物与内标的峰面积比计算fu值即可;而对于需申报的确证性研究(如药物开发候选物),则建议采用标准曲线法,以确保获得高质量数据用于DDI预测和监管申报。计算时仅采用线性范围内的质谱响应值。实验接受的标准通常为:至少3个有效重复、变异系数(CV)≤30%、化合物稳定性≥70%(部分实验室规定85%-115%)。
二、 使用RED装置的标准方法
装置与加样:使用RED装置(接收池材质为高密度聚丙烯)。向供体池加入220 μL含2 μmol/L测试化合物的血浆,向接收池加入350 μL不含钙和镁的PBS缓冲液。
孵育条件:装置用使用透气性密封膜覆盖,置于37°C、湿度75%、含5% CO2/95% O₂气体的培养箱中,在450 rpm的摇床上孵育4小时。
特异性取样:(1)孵育前,取15 μL“时间零点(又称”初始时间点“)”血浆(含2 μmol/L化合物)加入含45 μL PBS和200 μL含内标冷乙腈液的孔中,混匀离心取上清液,进行分析,用于评估回收率和稳定性。(2)孵育后,分别从供体池取15 μL血浆,以及从接收池取45 μL PBS,以及稳定性样品。分别补足相应空白基质进行“基质匹配”,以确保后续LC-MS/MS分析时供体与接收侧基质的一致性。
目的:此为测定PPB的标准方案。
三、使用HTD 96装置的方法
装置与膜准备:使用HTD 96平衡透析装置。实验前需预处理纤维素膜(分子截留MWCO 12-14 kDa):依次在去离子水中浸泡15分钟、在30%乙醇/去离子水中浸泡15分钟、最后在PBS中浸泡至少15分钟或过夜。然后按制造商说明组装装置。
加样:向膜一侧的供体池加入150 μL含2 μmol/L化合物的血浆,向另一侧的接收池加入150 μL PBS。
孵育条件:装置用使用透气性密封膜覆盖,置于37°C、湿度75%、含5% CO₂/95% O₂气体的培养箱中,在200 rpm的摇床上孵育足够时间以确保达到平衡。
取样与处理:孵育前后的取样和处理流程与RED标准方法完全相同(取15μL供体侧样品,取45μL接收侧样品并补加15μL空白血浆),随后用含内标的冷乙腈沉淀蛋白。
四、 针对高结合化合物的改进方法
过去普遍认为高结合率(低 fu)化合物 PPB 测定精密度低于低结合率化合物。但参考文献中对 2000 余个跨 4 个 log10单位 fu 值的分析显示:低/高fu化合物精密度(以变异系数 CV 衡量)没有显著差异——5个物种血浆的日内、日间实验平均 fu CV稳定在6%-11%。这一结果的核心原因在于,PPB 测定精密度由移液操作重复性、试剂一致性(如血浆 pH、缓冲液稳定性)、实验条件可控性(如培养箱温湿度、摇床转速)及 LC-MS/MS 检测灵敏度共同决定;而现代 LC-MS/MS
仪器的灵敏度已足以满足高结合率化合物的检测需求,因此不存在 “低 fu 值化合物测定精密度更低” 的系统性偏差。
PPB 测试的核心挑战集中于大分子量、高亲脂性、低溶解度及高结合率化合物(如伊曲康唑、胺碘酮),这类化合物的 fu 值测定难度主要源于两大关键问题:
(1)高非特异性结合:化合物易吸附于平衡透析装置的接收池壁或透析膜表面,导致实际检测量偏离理论值;仅供体池因存在大量可与化合物结合的血浆蛋白,蛋白会与非特异性结合位点竞争,该问题相对更轻微。
(2)平衡速度缓慢:体系需先饱和接收池的非特异性结合位点,才能进入真正的平衡状态;而低 fu 化合物的供体池中游离药物分子极少,大分子量化合物向接收池的扩散速率又低,二者共同导致平衡进程显著延缓。若未匹配足够孵育时间(如仍采用标准 4 小时),不仅测定数据易出现高变异性,还会因体系未达平衡导致结果不准确。
故此,为解决高结合率(低 fu)化合物PPB 测试的核心挑战科学家们基于平衡透析法提出了下面两个关键的测试策略:
1. 稀释法
步骤:将人体血浆用PBS缓冲液(pH 7.4)进行10倍或20倍稀释。将测试化合物加入稀释后的血浆中(终浓度2 μmol/L, 1% DMSO),然后对PBS进行透析。
原理:通过降低血浆蛋白浓度,来提高高结合率化合物的游离分数,使其易于准确测量。
2. 预饱和法(使用RED装置)
目的:减少化合物在透析装置(尤其是塑料表面)上的非特异性结合,从而提高对高结合化合物测量的准确性。
预饱和步骤:
(1)使用接收池材质为聚四氟乙烯(PTFE)的RED装置(与标准聚丙烯不同)。
(2)配制含有测试化合物(浓度约为其预估fu值的1倍、2倍和10倍)且含0.5% DMSO的PBS缓冲液。
(3)将该缓冲液加入供体池(250 μL)和接收池(380 μL)中,在37°C、450 rpm、5% CO₂/95% O₂的条件下预孵育30分钟,然后移除缓冲液。此过程重复两次,第三次预孵育过夜,以充分饱和装置表面的结合位点。
正式实验步骤:预饱和完成后,移除缓冲液,按RED标准方案进行实验,但需进行以下关键调整:
(1) 接收池中加入的PBS缓冲液含有相同浓度的测试化合物(约为预估fu的1×, 2×, 10×)。
(2) 供体池和接收池中的DMSO终浓度降至0.5%。
(3) 孵育时间延长至18小时(已验证适用于高结合化合物)。
(4) 始终使用聚四氟乙烯接收池。
(5) 平衡验证:如果从接收池中两种不同化合物浓度计算出的fu值一致,则表明系统已达到真正的平衡。
3. 计算公式
fu、稳定性(公式 (4))和回收率(公式 (5))的计算公式如下(公式 (1)-(3) 对应不同方法的 fu 计算),其中 D 代表稀释因子,“面积比”指分析物与内标的 MS 响应比值。
稀释法:稀释后的 fu,d = 接收池峰面积比/供体池峰面积比 (1)
稀释法:未稀释的fu=1/D÷[(1/fu,d)-1 + 1/D] (2)
预饱和法:fu= 接收池峰面积比/供体池峰面积比 (3)
稳定性(剩余百分比)=(最终时间点峰面积比/初始时间点峰面积比)×100% (4)
回收率(%)=(供体池面积比 + 接收池峰面积比)/初始时间点供体池峰面积比 ×100% (5)
五、案例
采用前面提及的血浆稀释法与预饱和法,针对三种高结合率化合物——伊曲康唑、UCN-01和胺碘酮——的血浆蛋白结合率(PPB)进行了系统测定。结果证实,这两种策略均可有效促进难结合化合物在透析体系中达到平衡,从而实现对极低未结合分数(fu)值的准确测定(此处边幅有限,更多案例可详阅参考文献)。
1. 伊曲康唑
特性:大分子量、高亲脂性,易与蛋白结合。
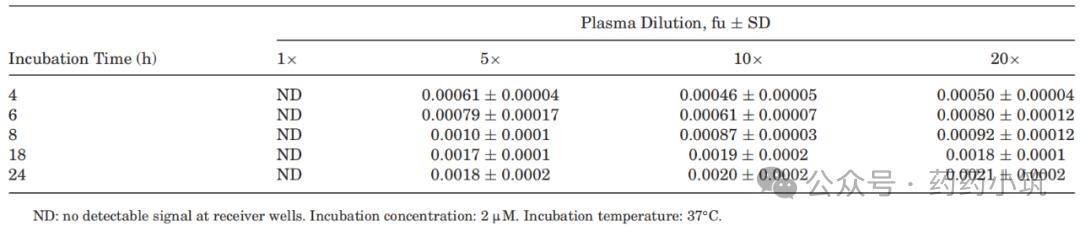
采用RED装置,研究评估了血浆稀释度与孵育时间对蛋白结合测定结果的影响(表1)。结果显示(表1):对于未稀释血浆,即使延长孵育时间至24小时,仍无法准确检测到游离分数(fu),其原因可能在于化合物与装置塑料壁或透析膜之间存在高度非特异性结合。而当采用5倍、10倍及20倍稀释血浆时,虽在孵育4小时后可检测到fu值,但体系并未达到完全平衡;进一步延长孵育时间至18小时及以上,fu值未出现显著的时间依赖性变化,表明18h体系已达到平衡状态。
表1 采用 RED 装置测定人血浆中伊曲康唑fu值时,血浆稀释度和孵育时间的影响
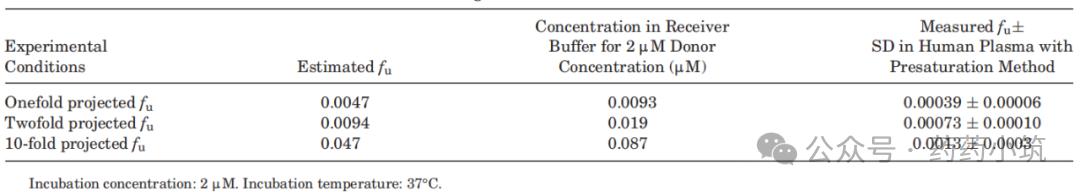
采用预饱和法测定伊曲康唑的游离分数(fu),由表2可知,在1×、2×及10×预估fu浓度下进行预饱和后,各条件下体系均达平衡,测得平均fu值为0.0022,与稀释法及文献报道值一致(表3)。
表2 采用预饱和法测定人血浆中伊曲康唑的游离分数
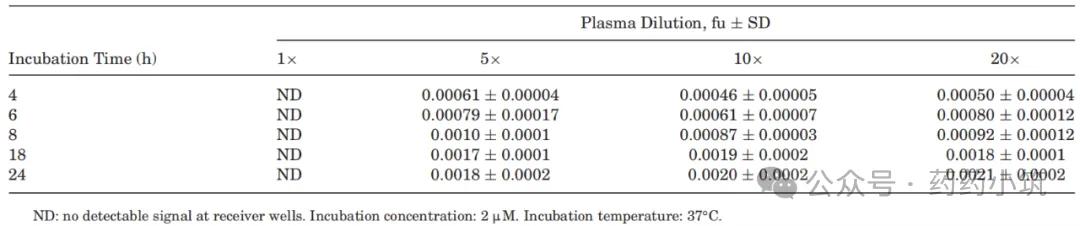
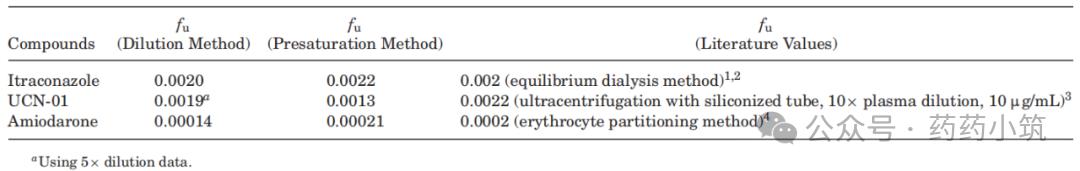
表3 采用不同方法测定难测化合物fu值的比较
2. UCN-01
特性:主要与AAG结合,种属间差异显著。
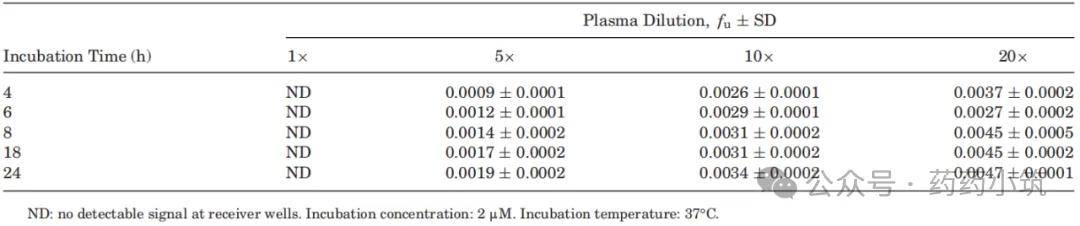
以UCN-01为模型药物,本研究评估了血浆稀释倍数与孵育时间对其血浆蛋白结合的影响。结果显示(表4),未稀释血浆中未能检测到UCN-01的游离分数(fu);经血浆稀释后则可成功测定,且fu值随孵育时间延长趋于平衡。随着稀释倍数从5倍提高至20倍,fu值出现轻微但显著的上升,提示可能与低蛋白浓度下AAG结合位点发生饱和有关。
在5倍稀释条件下,测得人血浆中UCN-01的fu值为0.0019,与文献采用硅化管超速离心法(可降低非特异性结合)所报结果0.0022相符(表3)。
表4 血浆稀释度和孵育时间对 AAG 结合药物 UCN-01人血浆fu值的影响
基于20倍稀释法预估的fu值,进一步采用预饱和法(预饱和浓度分别为该预估值的1×、2×及10×)测定UCN-01的fu值,所得结果(表5)与稀释法接近;未稀释血浆时UCN-01的fu估算值为0.0013,也与稀释法(5倍稀释条件0.0019)及文献中超速离心法(0.0022)的测定结果一致(表3)。
表5 采用预饱和法测定人血浆中 UCN-01 的游离分数
3. 胺碘酮
特性:极高亲脂性(logP=7.81),低溶解度。
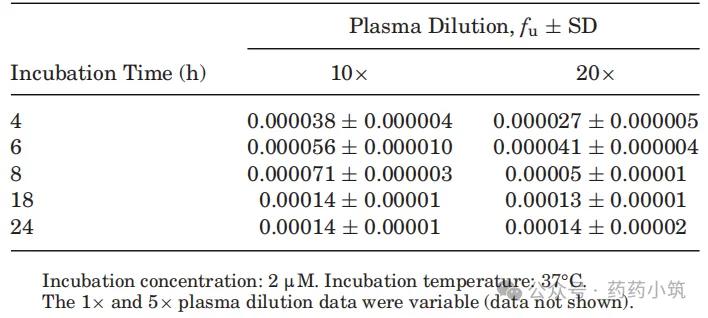
本研究以胺碘酮为模型化合物,探讨高结合药物PPB测定中的技术难点。实验采用HTD 96平衡透析装置(其接收池与膜表面积约为RED装置的1/4,有利于更快饱和非特异性结合位点)。结果显示,在未稀释或5倍稀释血浆中,胺碘酮的fu值变异较大;而使用10倍或20倍稀释血浆并孵育18–24小时后,fu值趋于稳定,平均为0.00014(表6),与红细胞分配法报道值0.0002相符(表3)。
表6 血浆稀释度和孵育时间对胺碘酮人血浆fu值测定的影响
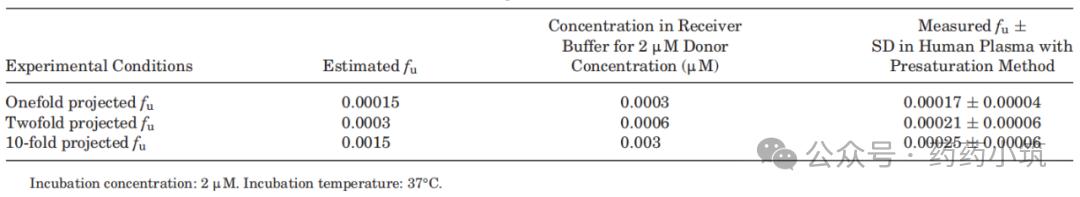
进一步基于上述稀释结果,分别以预估fu值的1×、2×和10×浓度进行预饱和实验(表7)。三种条件下所得fu值接近,平均值为0.00021,与稀释法及文献中红细胞分配法的结果一致(表3)。该结果表明,即使对于胺碘酮这类极具挑战性的高结合化合物,通过优化实验策略(如选择合适稀释倍数与预饱和条件),仍可实现对其极低fu值的准确测定。
表7 采用预饱和法测定人血浆中胺碘酮的游离分数
六、总结与建议
基于前述案例与多种方法的比较,并结合文献建议,在高结合率的化合物fu值测试中,可能以下实验策略与事项值得关注:
对于常规筛选阶段,可优先选用血浆稀释法,并适当延长孵育时间(例如18–24小时)以提高测定可靠性。需特别注意,平衡时间受实验装置类型与材质的显著影响。例如,RED装置因具有较大的比表面积且其聚丙烯材质易导致较高的非特异性结合,通常比HTD 96装置需要更长的孵育时间。因此,建议根据具体实验系统验证最佳孵育时长。
若怀疑药物主要与α₁-酸性糖蛋白(AAG)结合(如UCN-01案例),采用稀释法时需警惕蛋白饱和效应对结果的影响。虽然该现象并不常见,但当fu值随稀释倍数增加出现显著上升时,提示可能存在结合位点饱和。这是由于AAG在健康人血浆中浓度较低(约20–30 μmol/L),结合位点有限,对高结合率化合物进行高倍数稀释并使药物浓度达到2 μmol/L时,药物分子可能占据大部分有效位点,导致游离AAG浓度下降,从而使基于总蛋白浓度的稀释因子计算失效,最终高估fu值。此时应考虑降低稀释倍数或药物测试浓度,并采用预饱和法等非稀释方法进行验证,以规避因蛋白饱和或构象变化引致的误差。值得注意的是,血清白蛋白浓度较高(约600 μmol/L),通常不易发生饱和。

图1 高结合化合物血浆蛋白结合率的测定策略。* 仅当稀释法所得的未稀释(条件下的)游离分数(fu)与不进行血浆稀释的权威方法所得结果一致时,该fu值才被认可。
另外基于研究,参考文献建议将稀释法作为桥接研究策略,以满足监管机构对fu,d ≥ 0.01的基本要求,并将预饱和法或其等效方法作为高结合率化合物PPB测定的确定性方法(图1)。在进行高结合率化合物的DDI风险预测时,应采用由预饱和法或等效方法结合稀释法桥接研究得到的实测fu值,而非默认的0.01临界值。该策略不仅适用于血浆基质,还可扩展至组织、微粒体、肝细胞及其他体外孵育介质的结合测定研究。
通过上述方法的优化与系统验证,或许能够显著提高高蛋白结合率药物游离浓度测定的准确性与可靠性,从而为后续临床前及临床研究提供更坚实的数据基础。
参考文献:
[1] Riccardi K, Cawley S, Yates PD, Chang C, Funk C, Niosi M, Lin J, Di L. Plasma Protein Binding of Challenging Compounds. J Pharm Sci. 2015 Aug;104(8):2627-36. doi: 10.1002/jps.24506. Epub 2015 Jun 2. PMID: 26037784.
[2] Ryu S, Tess D, Di L. Addressing the Accuracy of Plasma Protein Binding Measurement for Highly Bound Compounds Using the Dilution Method. AAPS J. 2022 Dec 5;25(1):7. doi: 10.1208/s12248-022-00774-2. PMID: 36471200.
[3] Ryu S, Riccardi K, Patel R, Zueva L, Burchett W, Di L. Applying Two Orthogonal Methods to Assess Accuracy of Plasma Protein Binding Measurements for Highly Bound Compounds. J Pharm Sci. 2019 Nov;108(11):3745-3749. doi: 10.1016/j.xphs.2019.08.004. Epub 2019 Aug 13. PMID: 31419399.
免责声明:本文仅作知识交流与分享及科普目的,不涉及商业宣传,不作为相关医疗指导或用药建议。文章如有侵权请联系删除。
本公司产品推荐:
1.2033057-22-4 https://www.bicbiotech.com/product_detail.php?id=6459
2.2033057-23-5 https://www.bicbiotech.com/product_detail.php?id=6460
3.1863952-15-1 https://www.bicbiotech.com/product_detail.php?id=6461
4.1360883-22-2 https://www.bicbiotech.com/product_detail.php?id=6462
5.856970-31-5 https://www.bicbiotech.com/product_detail.php?id=6463




