在上市药物中,约40%属于难溶性药物。在早期药物研发管线中,这一比例更高,接近70%-90%的候选化合物存在溶解度低的问题。这意味着大量有潜力的候选药物因为难以在体内有效溶解和吸收,而不得不中止开发。这些药物多被归类为生物药剂学分类系统(BCS)II类(低溶高渗)或IV类(低溶低渗)。BCS II类在难溶性候选药物中占比约70%,BCS IV类占比约20%。难溶性的根源在于分子本身高疏水性和强大的分子间作用力,这直接体现在其高LogP、高熔点、高刚性等结构特征上。这不仅是一个简单的“溶解”问题,更是一个会引发生物利用度低、变异大、毒理评价困难、制剂开发复杂且昂贵等一系列连锁反应的系统性开发难题。因此,在现代药物发现中,科学家们会尽早运用计算机辅助药物设计(CADD)和体外高通量筛选,在优化药效(Potency)和选择性(Selectivity)的同时,尽力规避上述不良的分子物理化学属性,力求在分子结构层面就平衡好“药效”与“成药性”之间的矛盾。对于无法规避的难溶性候选药物,则需要早期介入,系统地评估并选择最合适的制剂赋能策略,以推动其顺利通过开发流程。
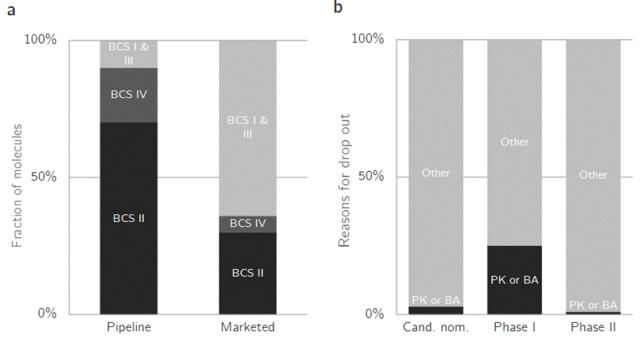
图1药物开发中的损耗统计数据。a在研发管线药物和已上市药物中,生物药剂学分类系统(BCS)各类别的分布情况,显示低溶解度的BCS II类和IV类药物存在明显的损耗。b 在开发过程中导致损耗的原因。由于在候选药物提名过程中未能完全排除相关问题,药代动力学或生物利用度问题导致的损耗在I期临床试验阶段最高(达25%)。为了更好进行药物制剂的开发,明确难溶性药物可能带来的问题也是尤为重要,这篇小文将深入去探讨难溶性药物可能给药物开发带来哪些沉痛的灾难:
1.生物利用度低且变异大:
①生物利用度低:众所周知,口服药物要进入体循环,必须经历这样一个过程:药物固体制剂→崩解→溶出→溶解的药物分子→透过胃肠膜→进入血液循环。对于水溶性好的药物,溶出这一步很快,不是限制因素,吸收主要取决于渗透性(跨膜速率)。而对于难溶性药物,溶出是整个过程最慢、最受限的一步,成为吸收的“瓶颈”。由于药物溶解度低、溶出速度慢,在药物通过吸收部位(主要是小肠)的有限时间(通常为几小时)内,只有一小部分药物能溶解出来。结果造成大部分药物以未溶解的固体形式随粪便排出体外,真正能被吸收的剂量分数(Fa)很低。根据公式F=Fa×Fg×Fh(其中Fg和Fh是肠道和肝脏的首过效应),Fa低下直接导致了绝对生物利用度(F)低下。
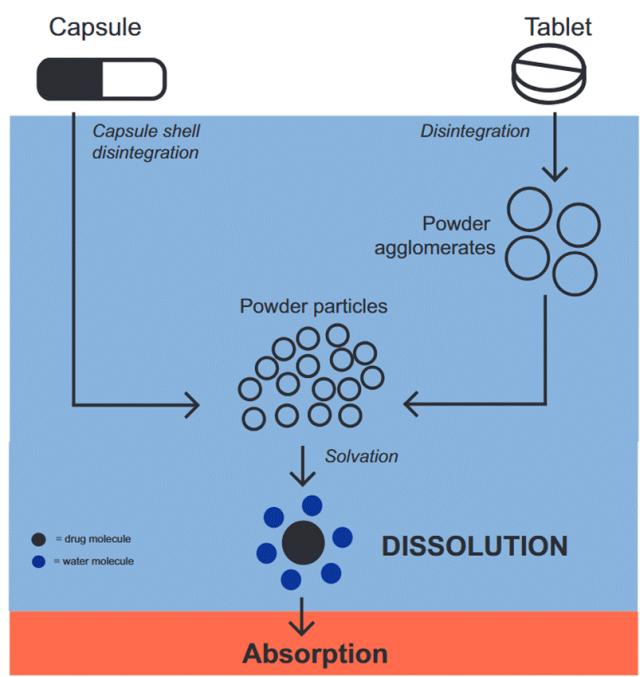
图2.含有物理粉末混合物的片剂和胶囊在胃肠道中的药物释放过程。片剂或胶囊进入胃肠道后,水(蓝色部分)引发其崩解。胶囊内装有松散填充的粉末,一旦胶囊壳崩解,粉末便与水接触。片剂首先崩解成大的粉末团块,然后进一步变成细小的粉末颗粒。最终,这些细小颗粒崩解为单个药物分子。当水分子包围药物分子时发生溶剂化,这导致药物溶出。只有溶解的药物分子才能被吸收进入血液循环(红色部分)
②吸收速率不稳定(导致变异大):这是变异性的主要来源。溶出速率受多种生理因素影响,而这些因素在不同个体、不同状态下差异很大。胃肠道pH值:对于pKa敏感的药物(如弱碱或弱酸),pH值直接影响其溶解度。例子:弱碱性药物在胃的酸性环境中溶解度较高,但胃排空后进入小肠(pH~6.5),溶解度可能急剧下降,导致药物沉淀。胃排空速率的快慢(受食物、个体差异影响)会极大影响它有多少时间在胃里溶解,从而造成暴露量的巨大变异。食物效应:食物会显著改变胃肠道环境。机制:①延迟胃排空,可能增加或减少药物在胃中的溶解时间。②刺激胆汁分泌:胆汁中的胆盐是一种天然的表面活性剂,可以增溶脂溶性药物,对某些难溶药是利好,但对另一些可能无效。③改变肠蠕动:影响药物在吸收部位的滞留时间。④与药物直接相互作用:高脂食物可能促进脂溶性药物的溶解和淋巴吸收。结果:同一个药物,空腹和餐后服用,其AUC和Cmax可能相差数倍,且这种效应在不同个体间无法预测。胆汁分泌与胃肠蠕动:个体间的胆汁分泌量、成分以及胃肠蠕动速度存在天然差异。对于依赖胆汁增溶的药物,胆汁分泌少的人吸收可能更差。胃肠蠕动快的人,药物可能来不及充分溶解和吸收就被排走。
2.缺乏剂量线性(Dose Proportionality):
什么是剂量线性?剂量线性(Dose Proportionality)是指,当给药剂量增加X倍时,衡量药物暴露量的关键药代动力学参数(主要是 AUC)也相应增加X倍。例如,剂量从50mg增加到100mg(2倍),AUC也从100 ng·h/mL增加到200 ng·h/mL(2倍)。在低剂量时,药物可能还能完全溶解并被吸收。但随着剂量增加,溶解过程达到饱和,吸收不再成比例增加,导致药时曲线下面积(AUC)无法随剂量线性增长,给临床剂量探索带来极大困难。拿漏勺接水来比喻:将肠道吸收比作用一个漏勺(肠道)去接从水龙头流出的水(药物), goal是在规定时间内用杯子接住漏下来的水(AUC)。低剂量(水龙头细流)时,所有水流都能顺利通过漏勺孔洞(溶解),并滴入杯子。水流加大一倍,接水量也加大一倍。(剂量线性);高剂量(水龙头全开)时,水流量太大,漏勺的孔洞(溶解度/溶出速率)来不及让所有水通过,大部分水直接从勺边流走(随粪便排出)。此时即使再把水龙头拧大(增加剂量),通过孔洞的水量(吸收量)也几乎不变,因为孔洞的通过能力已经饱和了。(缺乏剂量线性)。
3.临床前安全性评价受阻:
毒理学研究需要给予动物极高的剂量以找到最大耐受剂量(MTD)和未见不良反应剂量(NOAEL)。为了达到这些目的,必须给动物施用极高的剂量,以确保能够观察到潜在的毒性效应。这些剂量通常远高于预期的临床治疗剂量。对于易溶性药物,增加给药剂量通常会导致系统暴露量(如AUC、Cmax)成比例增加,直到达到MTD。但对于难溶性药物,由于其低溶解度和低溶出速率,其吸收存在一个明确的“天花板”或“饱和点”。一旦剂量超过某个点,暴露量便不再增加。如果药物难溶,无法通过常规方法(如混悬液)让动物达到足够高的暴露水平,就无法充分评估其毒性,可能导致有潜力的候选药物因无法完成毒理研究而夭折。
4.制剂开发难度大、成本高、周期长:
必须采用复杂且昂贵的“赋能策略”(Enabling Formulations),如纳米晶、无定形固体分散体(ASD)、脂质制剂(SEDDS/SMEDDS)、复合物(环糊精)等。这些技术工艺复杂,放大生产困难,对固态研究和处方筛选的要求极高,显著增加了开发时间和成本。例如,无定形固体分散体存在物理稳定性风险(重结晶),纳米晶存在奥斯特瓦尔德熟化和颗粒聚集等问题。
宋体; mso-no-proof:yes; ">
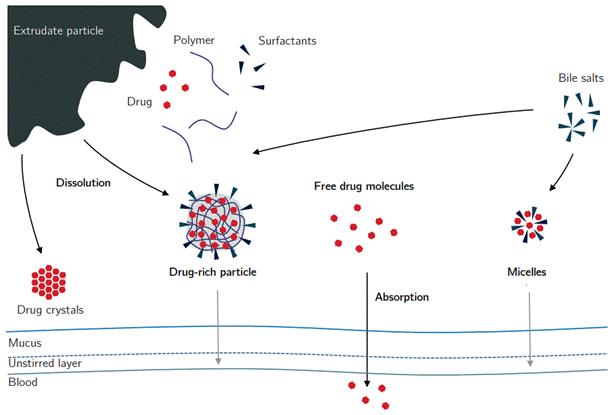
图3固体分散体的体内行为
5.体内外相关性(IVIVC)差:
由于药物溶解极慢,“溶出” 这一步成为了整个过程最慢的瓶颈。这意味着,药物的体内吸收速率和程度,完全取决于其溶出速率和程度。理论上,这应该是建立良好IVIVC的完美基础,因为体内的吸收曲线(通过血药浓度曲线反算)应该能够直接与体外的溶出曲线相关联。但是,由于溶出是限速步骤,体外溶出实验的条件(介质、转速)轻微变化就可能导致溶出行为巨大差异,使得体外数据难以准确预测体内行为,为质量控制带来挑战。体外方法稍有不慎,其溶出结果就“天差地别”,缺乏鲁棒性(Robustness)。具体可能得体外可变的条件如:
溶出介质pH值:对于pKa敏感的化合物(如弱酸、弱碱),介质pH 0.1个单位的变化,就可能导致溶解度发生百分比级别的显著变化,从而彻底改变溶出曲线形态。
表面活性剂浓度:为了模拟胆汁的增溶作用,体外溶出介质中常加入少量表面活性剂(如SDS、吐温80)。其浓度从0.1%到0.5%的微小变化,就可能极大地改变药物的润湿性和溶解度,使溶出速率倍增或锐减。
转速/搅拌效率:溶出仪桨板转速(如50转 vs 75转)的差异,会改变药物颗粒表面的液体静力层厚度,从而显著影响扩散速率。对于溶出本身就很慢的药物,这种差异会被放大。
介质离子强度:离子强度的变化可能影响药物的溶解度(盐效应)和表面活性剂的临界胶束浓度(CMC)。
6.商业化挑战:
最终的制剂可能体积庞大(例如,需要服用多个胶囊或大片剂),或者需要特殊的包装和储存条件(如避湿、冷藏),影响患者的依从性和产品的市场竞争力。难溶性药物往往效力(Potency)不高,这意味着需要给予一个较大的绝对剂量(例如,200mg甚至500mg)才能产生疗效。大多数先进的增溶技术(如固体分散体、纳米晶、脂质制剂)都会加入大量的功能性辅料,例如固体分散体:需要大量聚合物(如HPMC、PVP)来稳定无定形态药物。最终的产品中,API(主药)的占比(载药量)可能仅为10-30%。一个200mg剂量的药物,由于载药量只有25%,加上辅料后的总质量可能达到800mg。这远远超过了标准00号胶囊的容量(约600mg),可能需要填充两个超大号胶囊甚至三个标准胶囊。对于片剂,则可能需要压制成一个患者难以吞咽的超大片。
案例:奥拉帕利是一种聚ADP核糖聚合酶(PRAP)抑制剂,而PARP被抑制可引起细胞周期阻滞于G2/M期,最终诱导细胞凋亡。由于奥拉帕尼难溶,需要先进的药物递送技术来确保生物利用度,最初批准的400mg剂量为八粒50mg胶囊,每日两次,而后开发了一种热熔挤出片剂处方(开发为固体分散体),以改善奥拉帕尼的药代动力学和药效学特征,并减轻患者的给药负担。推荐的片剂剂量为300mg,每日两次(两片150mg片剂)。
制剂体积过大造成患者用药负担重:每天服用多次、每次需要吞服多个大胶囊或大片剂,让患者(尤其是老年和吞咽困难患者)感到不适和抗拒;复杂的包装(如需要自行组装)和苛刻的储存条件(如必须冷藏)容易导致患者出错(如忘记冷藏、误服剂量),影响疗效甚至带来安全风险。依从性差直接导致临床疗效打折,在真实世界研究中表现不佳。
复杂的生产工艺(如热熔挤出、高压均质、喷雾干燥)和特殊的包装材料(高阻隔包材、干燥剂)导致制造成本远高于普通片剂。高昂的成本最终会转嫁给支付方(医保、患者),使得药品价格缺乏竞争力。如果市场上存在替代疗法(即使是疗效稍差但价格低廉的普通制剂),患者和医生可能不会选择这款“昂贵且难用”的药物。繁琐的用药要求会给产品贴上“用户不友好”的标签,影响其市场口碑和接受度。
总之,难溶性药物的出现是难以避免的,现实问题也是存在的,知其难而勇进,才是我们制剂人应该采取的态度,更重要的是如何掌握克敌制胜奇招,妙招。路漫漫其修远兮,吾将上下而求索。
参考文献
1.Amorphous Solid Dispersions as Oral Delivery System for Poorly Soluble Drugs–Mechanistic and Translational Research
2.Solid dispersions in oncology: a solution to solubility-limited oral drug absorption
3.Development and Production Application Cases of Amorphous Solid Dispersion Formulations (I) - Hot Melt Extrusion
免责声明:本文仅作知识交流与分享及科普目的,不涉及商业宣传,不作为相关医疗指导或用药建议。文章如有侵权请联系删除。
本公司产品推荐:
1.102029-73-2 https://www.bicbiotech.com/product_detail.php?id=6487
2.1926-57-4 https://www.bicbiotech.com/product_detail.php?id=6488
3.54120-64-8 https://www.bicbiotech.com/product_detail.php?id=6489
4.3406-02-8 https://www.bicbiotech.com/product_detail.php?id=6490
5.3238-40-2 https://www.bicbiotech.com/product_detail.php?id=6491




