
基因调控元件在人类大脑发育和疾病病因中扮演着重要角色。过去数十年里,科学家们通过实验和计算预测的方法,已经鉴定出许多潜在的基因调控元件和与发育中大脑疾病相关的遗传变异。然而,由于这些元件具有细胞类型特异性活性,我们对核苷酸变化如何影响基因调控的了解有限,加之高通量功能检测的局限性,对这些元件的功能表征以及研究DNA核苷酸变异如何导致疾病成为一大挑战。
近年来,基于慢病毒的大规模并行报告分析(lentiMPRA)技术的发展为克服这些限制提供了可能。这项技术能够在难以转染的细胞中测试数千个序列和变体的调控活性,例如神经元和大脑类器官。通过大量定量活性数据,可以训练机器学习模型预测功能性和细胞类型特异性的调控元件,并执行大规模的计算机模拟实验,以确定改变增强子活性的核苷酸变异。
尽管已有研究在基因调控元件的识别和功能研究方面取得了进展,但如何精确地将这些元件与特定细胞类型及其在大脑发育中的作用联系起来,仍是当前研究的一个空白。此外,对于非编码区域的遗传变异如何通过远程调控机制影响基因表达和大脑发育,我们的理解还远远不够。
本研究通过结合lentiMPRA技术和深度学习,对中期妊娠人类皮层细胞和大脑类器官中的超过10万个候选调控元件和变体进行了评估。这包括在发育中大脑特定细胞类型的可接近染色质中的序列,以及与精神疾病相关的变体。通过比较在原代细胞和大脑类器官中的结果,研究者能够评估类器官是否可以有效作为体外模型用于MPRA研究。此外,通过训练一个基于序列活性的神经网络模型,研究者能够学习实验结果中编码的调控语法,从而预测核苷酸变化对增强子功能的影响。
这项研究不仅为理解人类大脑发育中的调控代码提供了新的视角,而且还生成了能够预测核苷酸变化如何扰乱调控元件的工具。这对于揭示基因调控变体如何导致表型效应具有重要意义,同时也为精神疾病的早期诊断和治疗提供了潜在的靶点。
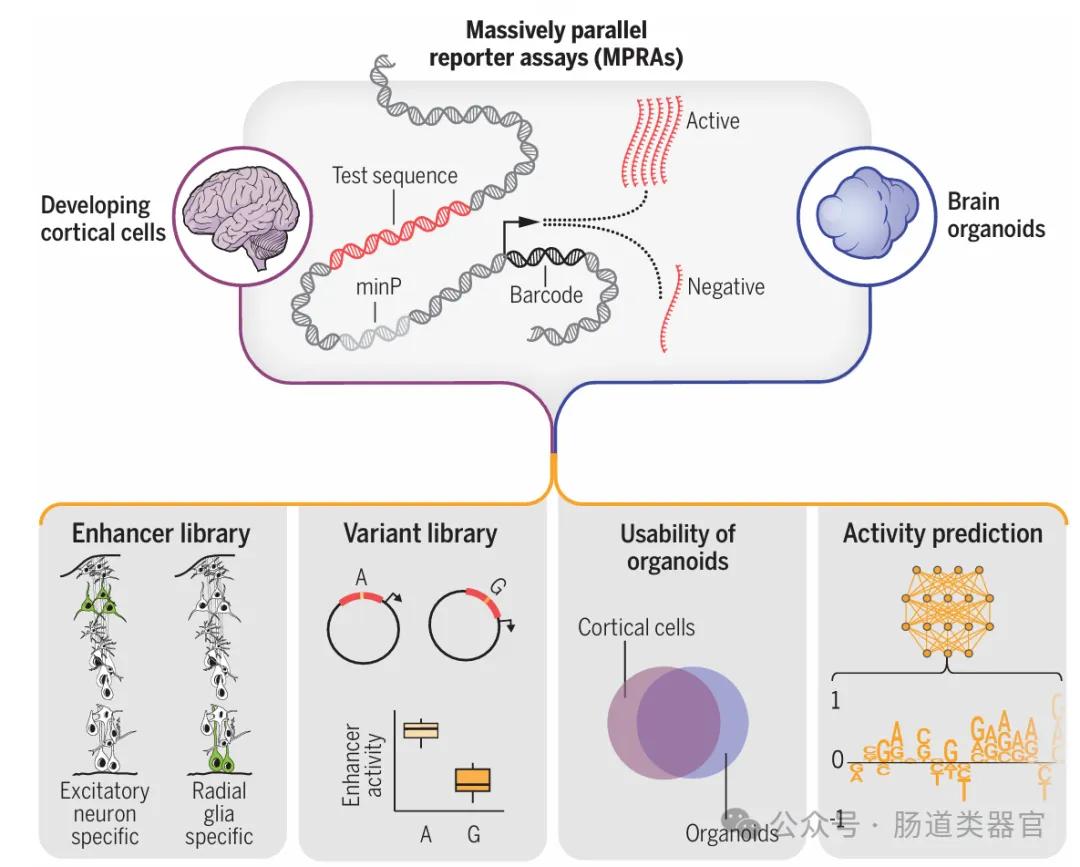
基因调控元件在人类大脑发育和疾病病因中扮演着重要角色。尽管已有研究通过实验和计算预测方法鉴定出许多潜在的基因调控元件和与发育中大脑疾病相关的遗传变异,但这些元件的功能表征以及DNA核苷酸变异如何导致疾病仍然是一个挑战。Deng等人的研究通过结合慢病毒大规模并行报告分析(lentiMPRA)技术和深度学习,对中期妊娠人类皮层细胞和大脑类器官中的调控元件和变体进行了大规模评估。
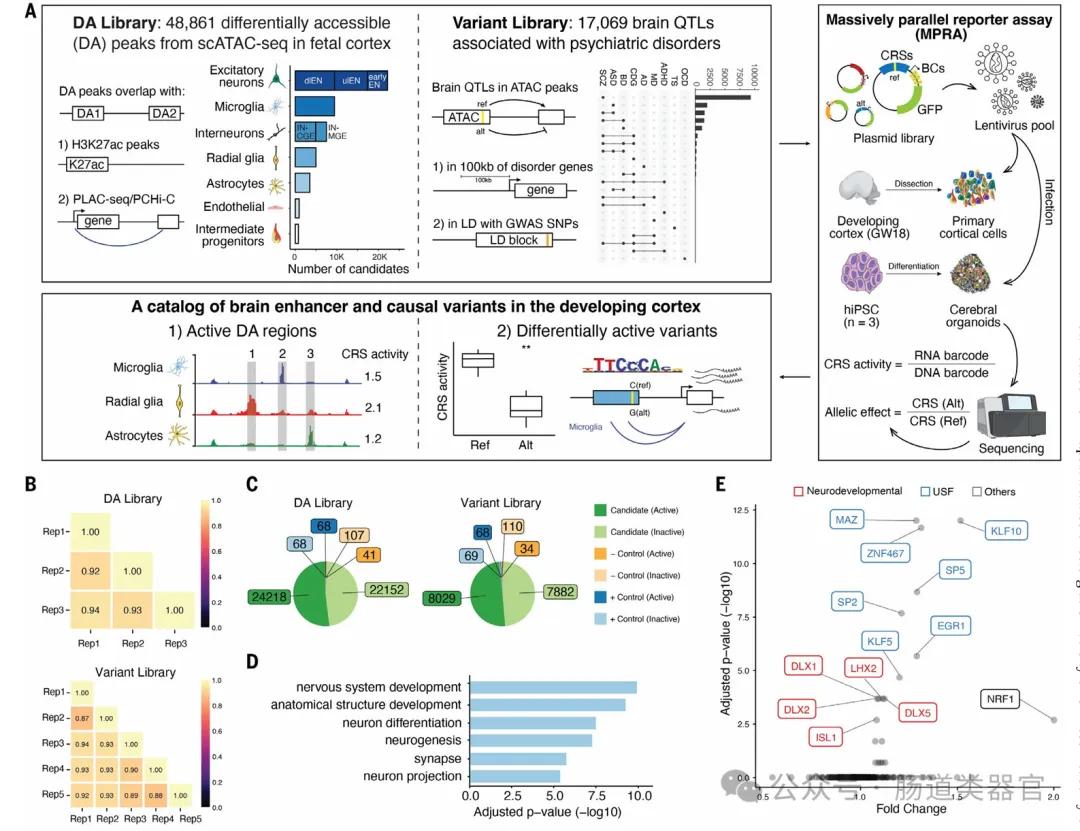
研究团队首先提出了一个假设,即通过lentiMPRA技术能够在原代细胞和大脑类器官中测试大量序列和变体的调控活性,并利用深度学习模型预测功能性和细胞类型特异性的调控元件。他们设计了两个lentiMPRA库,一个用于表征候选细胞类型特异性增强子的调控潜力,另一个用于比较17,069个变体的参考和替代等位基因的调控活性。实验结果显示,在原代细胞中鉴定出46,802个活性增强子序列,并发现164个与精神疾病相关的变体在人类皮层细胞中表现出等位基因间的增强子活性差异。
研究中的关键发现是,大脑类器官和原代细胞在lentiMPRA实验中表现出高度一致的活性,这表明类器官可以作为研究发育皮层调节景观的适当模型。此外,深度学习模型能够以最先进的准确性预测lentiMPRA活性,这使得研究者能够学习人类大脑发育中调控活性的序列决定因素,并将转录因子分类为抑制因子与激活因子,并预测对调控活性有重大影响的核苷酸变化。
研究结果强调了大脑类器官作为研究工具的潜力,并揭示了与精神疾病相关的基因调控活性的变体。Deng等人的工作不仅增进了我们对人类大脑发育调控代码的理解,而且还生成了能够预测核苷酸变化如何扰乱调控元件的工具。这些发现对于理解基因调控变体如何导致表型效应具有重要意义,并为精神疾病的早期诊断和治疗提供了潜在的靶点。
然而,研究也存在一些局限性。例如,MPRAs虽然能够测量序列的调控活性,但并不能确定其目标基因。此外,由于技术限制,当前方法难以在混合细胞群体中检测细胞类型特异性调控元件。尽管如此,该研究为未来的研究提供了新的方向,包括利用单细胞技术或纯化的细胞群体来验证更大数量的序列,以及利用CRISPR筛选来评估候选调控序列的内源活性。这些策略的整合将是破译人类大脑发育调控代码的关键步骤。
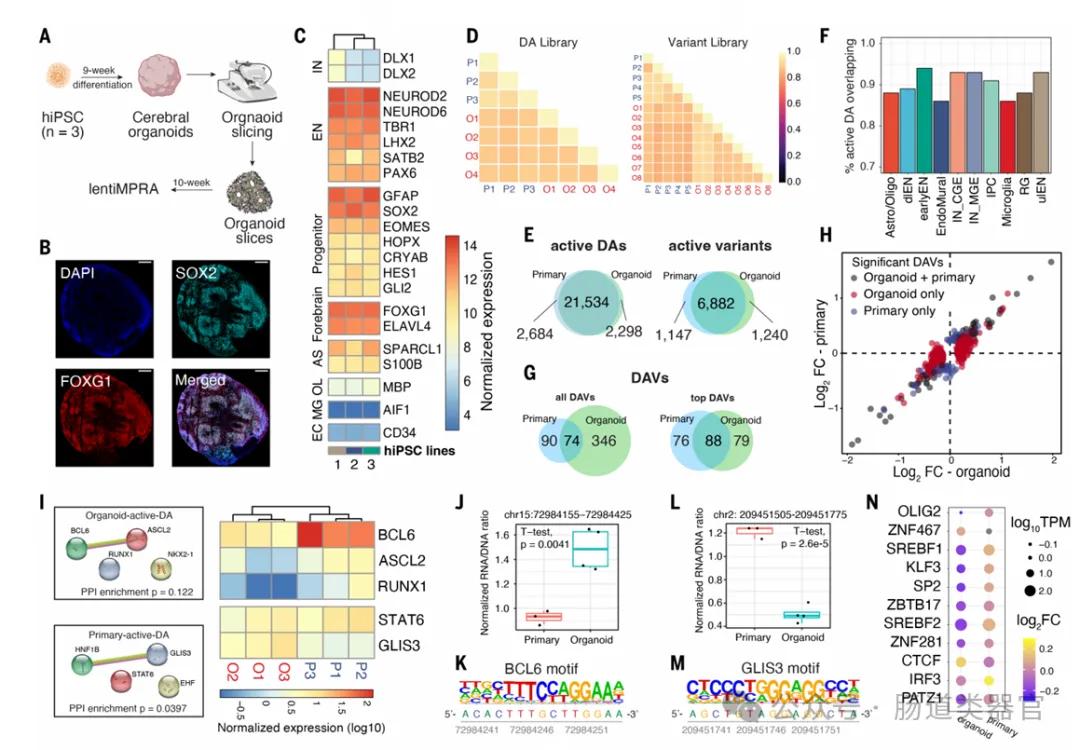
在这项研究中,大脑类器官的应用是至关重要的,因为它们提供了一个体外模型来模拟人类大脑发育过程中的调控元素活性。类器官是由多能干细胞衍生的三维细胞培养物,能够在一定程度上模拟大脑的结构和功能。研究者利用这些类器官来测试和比较在发育中的大脑中特定细胞类型的基因调控元件的活性。
研究中使用了10周龄的大脑类器官,并通过免疫染色、RNA测序等方法验证了它们表达相关细胞类型标记物的表达。这些类器官被切割成薄片,并感染了包含候选调控序列的慢病毒lentiMPRA库。通过这种方式,研究者能够在类器官中评估这些序列的增强子活性,并与原代皮层细胞中的活性进行比较。
结果显示,类器官和原代细胞在lentiMPRA实验中表现出高度的活性一致性,这表明大脑类器官可以作为一个有效的体外模型来研究人类大脑发育中的基因调控。此外,类器官的应用还揭示了一些细胞类型特异性的调控元件,这些元件在原代细胞中可能难以检测到,因为它们在混合细胞群体中的活性可能被稀释。
此外,大脑类器官还用于识别与精神疾病相关的基因调控变体。研究者在类器官中发现了一些与精神疾病相关的变体显示出等位基因间的增强子活性差异,这为理解这些变体如何影响大脑发育和精神疾病的风险提供了新的视角。
总的来说,大脑类器官在这项研究中的应用展示了它们在模拟人类大脑发育、识别和表征基因调控元件以及研究精神疾病相关遗传变异方面的潜力。然而,研究者也指出,尽管类器官是一个有用的模型,但在解释lentiMPRA结果时,需要仔细考虑细胞类型组成和转录调控环境的差异。未来的工作可能会考虑使用类器官lentiMPRA方法来测试来自不同精神疾病或非人灵长类动物iPSCs的库,以及利用单细胞MPRAs和CRISPR筛选等技术来进一步扩展这项研究。
这项研究的创新之处在于其结合了慢病毒大规模并行报告分析(lentiMPRA)技术和深度学习来探索和理解人类大脑发育中的基因调控元件。以下是该研究的几项创新点:
1.高通量功能基因组学与机器学习的结合:研究者不仅利用lentiMPRA技术对超过10万个候选调控元件和变体进行了评估,而且还开发了深度学习模型来预测调控活性,这种方法的结合在以往的研究中并不常见。
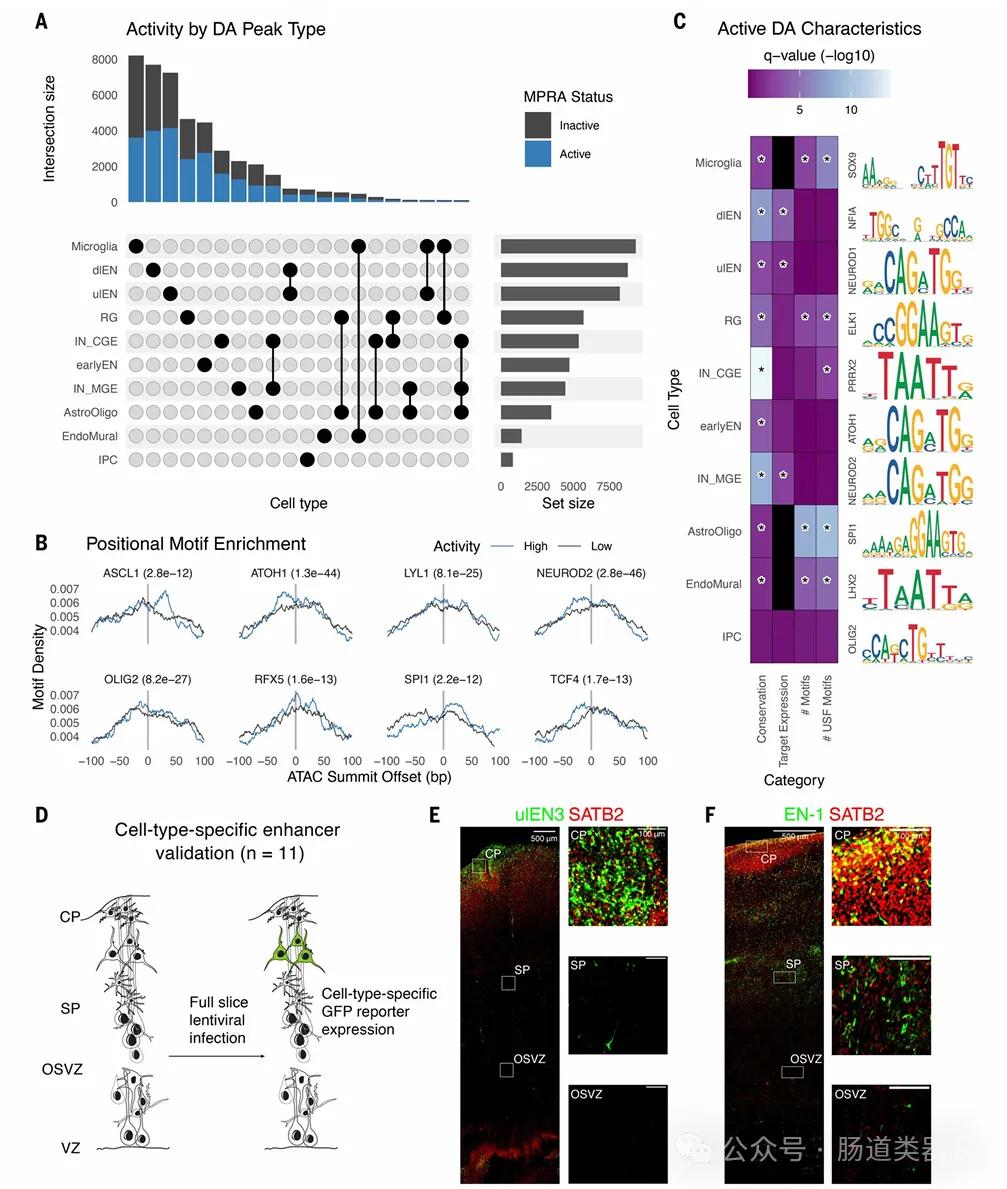
2.细胞类型特异性活性的预测:通过训练的深度学习模型,研究者能够预测特定细胞类型的调控元件活性,这对于理解大脑中不同细胞类型的特异基因表达调控具有重要意义。
3.大规模的基因调控元件目录创建:研究生成了一个大规模的目录,包含了在中期妊娠人类皮层细胞和大脑类器官中活跃的基因调控元件,这为未来的研究提供了宝贵的资源。
4.精神疾病相关遗传变异的功能表征:研究鉴定了与精神疾病相关的164个变体,并分析了它们在人类皮层细胞中的增强子活性差异,这有助于揭示这些变异如何影响大脑发育和疾病风险。
5.大脑类器官作为模型系统的验证:研究中大脑类器官的应用不仅展示了它们作为研究人类大脑发育的工具的潜力,而且还验证了它们在模拟原代细胞中的调控活性方面的有效性。
6.解释性人工智能技术的应用:通过应用称为in silico mutagenesis的解释性人工智能技术,研究者能够学习调控活性的序列决定因素,并预测对调控活性有重大影响的核苷酸变化。
7.对转录因子功能的预测和分类:研究中深度学习模型的应用还允许研究者在特定细胞类型背景下对转录因子作为激活因子或抑制因子的功能进行分类。
这些创新的方法和技术的应用极大地推进了我们对人类大脑发育中调控元件功能的理解,为研究精神疾病的遗传基础提供了新的工具和策略。
尽管Deng等人的研究在基因调控元件的研究领域取得了显著的进展,但仍存在一些不足之处:
1.细胞类型特异性的挑战:虽然研究中使用了lentiMPRA技术来评估细胞类型特异性的调控元件,但该技术在检测混合细胞群体中的稀有细胞类型时可能存在限制。这可能导致某些细胞类型特异性的调控元件未能被准确识别。
2.目标基因的不确定性:MPRAs技术可以测量序列的调控活性,但通常不直接识别其目标基因。这限制了对调控元件功能影响的全面理解。
3.技术局限性:lentiMPRA技术虽然能够高通量地测试多个序列,但测试的是短序列(270-bp),这可能不足以捕捉到那些需要更广泛染色质环境来实现细胞类型特异性的调控元件。
4.转录调控环境的差异:尽管大脑类器官在模拟人类大脑发育方面具有潜力,但它们在细胞类型组成和转录调控环境方面与原代细胞存在差异。这可能影响对调控元件活性的解释。
5.与成人大脑QTLs的比较:研究中使用的是成人大脑的QTLs,而不是发育中的大脑QTLs,这可能限制了对神经发育障碍相关基因的发现。
6.效应大小的相关性:研究中观察到的单核苷酸多态性(SNPs)对调控活性的影响通常较小,这可能限制了它们在功能性研究中的相关性。
7.实验与内源性基因表达的关联:MPRAs通常测量报告基因的活性,而不是内源性基因的表达,这可能在将实验结果与内源性基因调控联系起来时带来挑战。
8.数据解释的复杂性:尽管深度学习模型能够预测调控元件的活性,但模型的解释性和预测的生物学意义需要进一步的实验验证。
9.实验复制性和普适性:研究中的方法和发现需要在其他实验室和不同的人群中复制,以确保结果的普适性和可靠性。
10.伦理和安全性问题:使用人类干细胞和类器官技术涉及伦理和安全性问题,需要在研究中仔细考虑。
这些不足之处提示了未来研究需要解决的问题,并为改进现有技术和方法提供了方向。
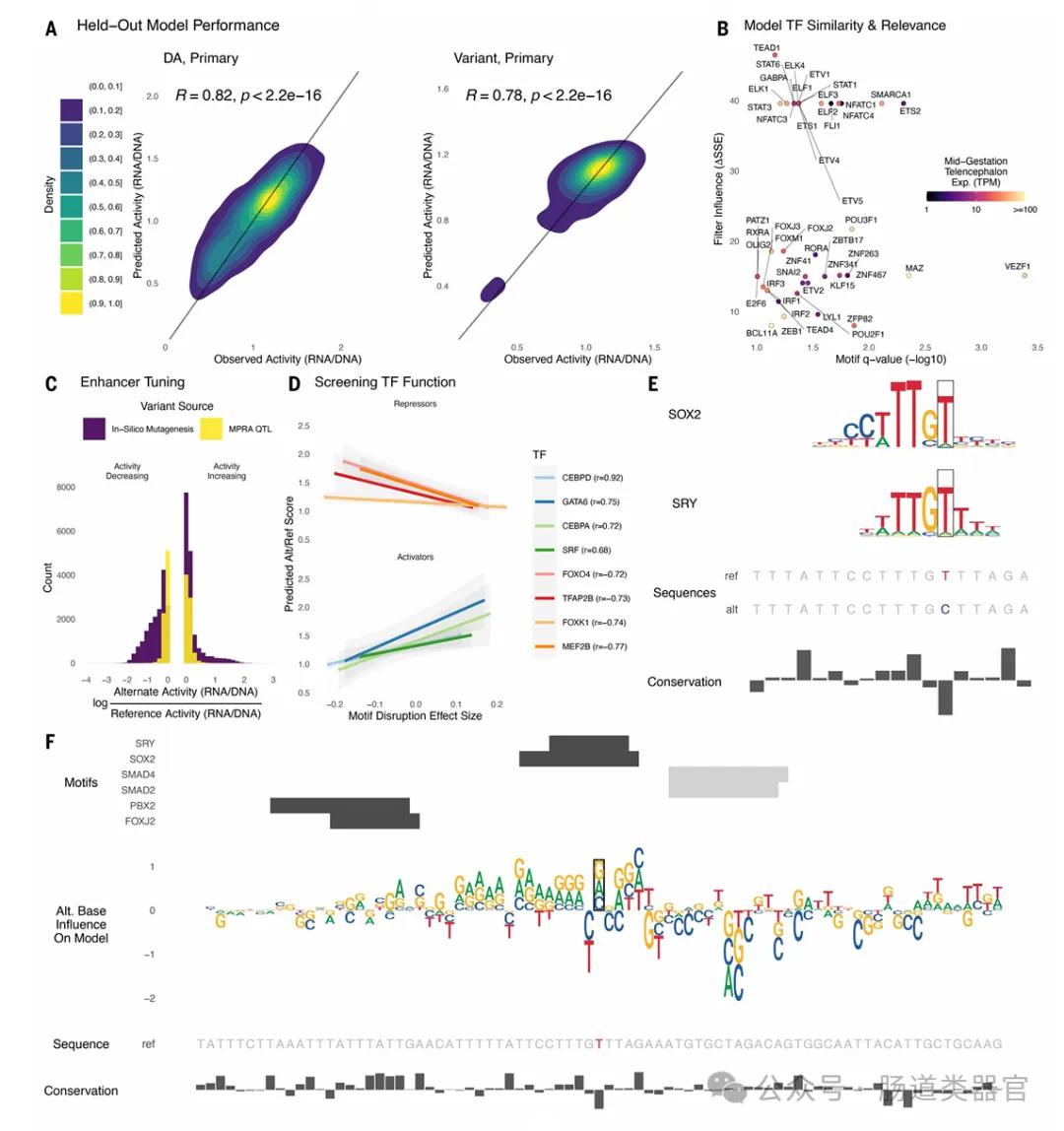
Deng等人的研究通过结合慢病毒大规模并行报告分析技术和深度学习,对人类大脑发育中的基因调控元件进行了深入分析,其价值和意义在于为理解大脑发育的分子机制提供了新的视角,揭示了与精神疾病相关的基因调控变体,并为早期诊断和治疗精神疾病提供了潜在的靶点。此外,该研究还验证了大脑类器官作为模拟人类大脑发育的体外模型的可行性,并展示了机器学习在预测细胞类型特异性调控元件方面的潜力。通过建立大规模的功能性基因调控元件目录,这项工作不仅增进了我们对人类大脑发育调控代码的理解,而且为未来的基因组学、神经生物学以及相关疾病机理的研究奠定了坚实的基础。




